2022年2月18日,我院完成国家“医疗器械临床试验机构备案管理信息系统”备案(备案号: 械临机构备202200016),并于2022年4月28日顺利通过现场监督检查。这标志着我院具备了开展相关医疗器械和体外诊断试剂临床试验研究的资质,我院临床试验工作及科研水平也将迈上一个新的台阶。
2017年11月15日,原国家食品药品监督管理总局会同国家卫生计生委联合发布了《医疗器械临床试验机构条件和备案管理办法》。该《备案办法》规定,自2019年1月1日起,医疗器械临床试验应在已经备案的医疗器械临床试验机构中开展,未经备案将不能开展医疗器械临床试验。
为响应国家号召,顺应我市加快医药产业升级提速及科技创新发展的要求,我院于2021年7月正式启动国家药物/医疗器械临床试验机构筹建工作,及时召开了临床试验机构备案启动会,组建了机构办公室、临床试验伦理委员会、专业科室、辅助科室各部门临床试验工作组,组织各部门学习研究相关政策法规,全体成员分工负责,制定了临床试验相关的管理制度、标准操作规程、应急预案、急救预案、仪器操作等文件,进行了相关的法律法规、制度SOP培训,完成了相关设施设备的建设采购。
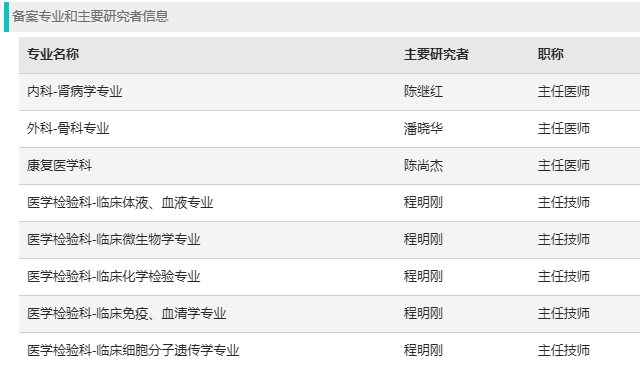
在院领导及相关科室的大力支持下,我院顺利完成资料申报,并通过了审核,成功备案。此次成功备案的科室包括:内科-肾病学专业、外科-骨科专业、康复医学科、医学检验科4个专业。
备案成功后,我院即具备在这4个专业领域进行医疗器械和体外诊断试剂临床试验资质,可开展医疗器械和体外诊断试剂相关临床试验。各部门将秉着对临床试验价值和风险的正确认识和敬畏之心,严格按照相关GCP要求,加强对试验项目的质量管控,促进临床试验质量不断提高。
医疗器械临床试验机构的成功备案标志着我院临床试验工作又跨上了一个新的台阶。同时,我院将持续进行国家药物临床试验机构的筹建工作,进一步拓展我院临床试验的业务范围,建设国际国内创新科研交流平台,早日满足我院药物临床试验申报专业参与高水平、多中心药物临床试验研究的需求,助力我院医教研及新型药物/医疗器械临床研究水平的提升,促进我院的科研创新蓬勃发展。