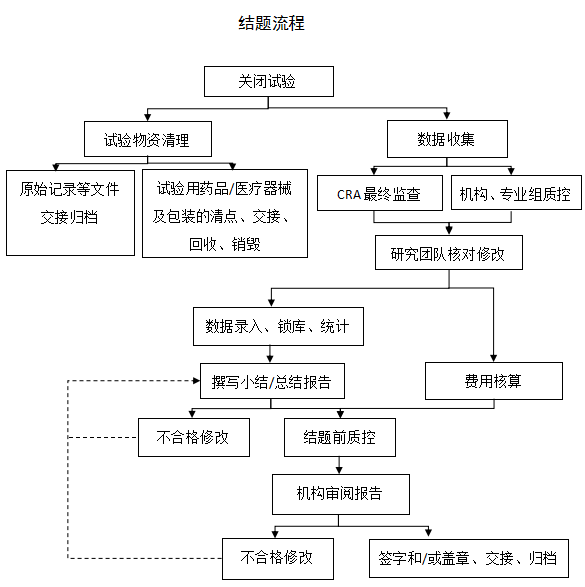
详细流程:
1.小结/总结报告撰写完成后,告知机构办公室对项目进行结题前质控。
2.申办者自查。申办者根据《药物临床试验必备文件保存指导原则》/《医疗器械/体外诊断试剂临床试验基本文件目录》、《药物临床试验数据现场核查要点》/《医疗器械临床试验项目检查要点及判定原则》(所有表格在“下载专区”查看)对结题资料进行自查。
3.结题前质控。项目组质量管理员与机构质量管理员分别完成质控检查,项目团队确保质控反馈问题得到解决。
4.物资交接。试验用药品由申办者/CRO与机构GCP药房交接,试验医疗器械由机构办公室、专业组与申办者/CRO三方共同交接。PI将通过质量控制的项目资料递交至机构办公室审查,并对审查相关问题进行回复解释。
5.费用核算。申办者/CRO与主要研究者先沟通、核算实际发生金额,机构予以确认,结清所有费用。
6.PI确认全部试验经费到账,机构质量管理员所反馈问题全部得到解决后,递交《药物临床试验项目结题表》/《医疗器械临床试验项目结题表》进行结题。结题完成后,机构办公室将已盖章和/或签字的报告交申办者/CRO。